REDACCIÓN. El gigante farmacéutico Pfizer continúa avanzando en las pruebas de su vacuna contra el COVID-19, y para finales de noviembre, espera solicitar a la Administración de Alimentos y Medicamentos de EEUU (FDA, por sus siglas en inglés), una autorización de emergencia para la distribución del fármaco, según informó el CEO de la compañía, Albert Bourla.
“Permítanme ser claro, si los datos son positivos Pfizer solicitará la autorización de emergencia en los EEUU; poco después de que culmine la etapa de seguridad, en la tercera semana de noviembre”, informó el directivo en una carta abierta.
La farmacéutica estadounidense es una de las tres empresas con las que México firmó acuerdos de compra el pasado 13 de octubre.
Áreas principales
“Hay tres áreas principales en las que, como con todas las vacunas, debemos demostrar el éxito a fin de obtener la aprobación para su uso público. Primero, la vacuna debe demostrar su eficacia; es decir, que puede ayudar a prevenir la enfermedad del COVID-19 en al menos la mayoría de los pacientes vacunados. Segundo, e igualmente importante, debe probarse que es segura; con datos robustos de seguridad generados a partir de miles de pacientes. Y finalmente debemos demostrar que puede ser producida constantemente con los más altos estándares de calidad”, señaló el CEO.
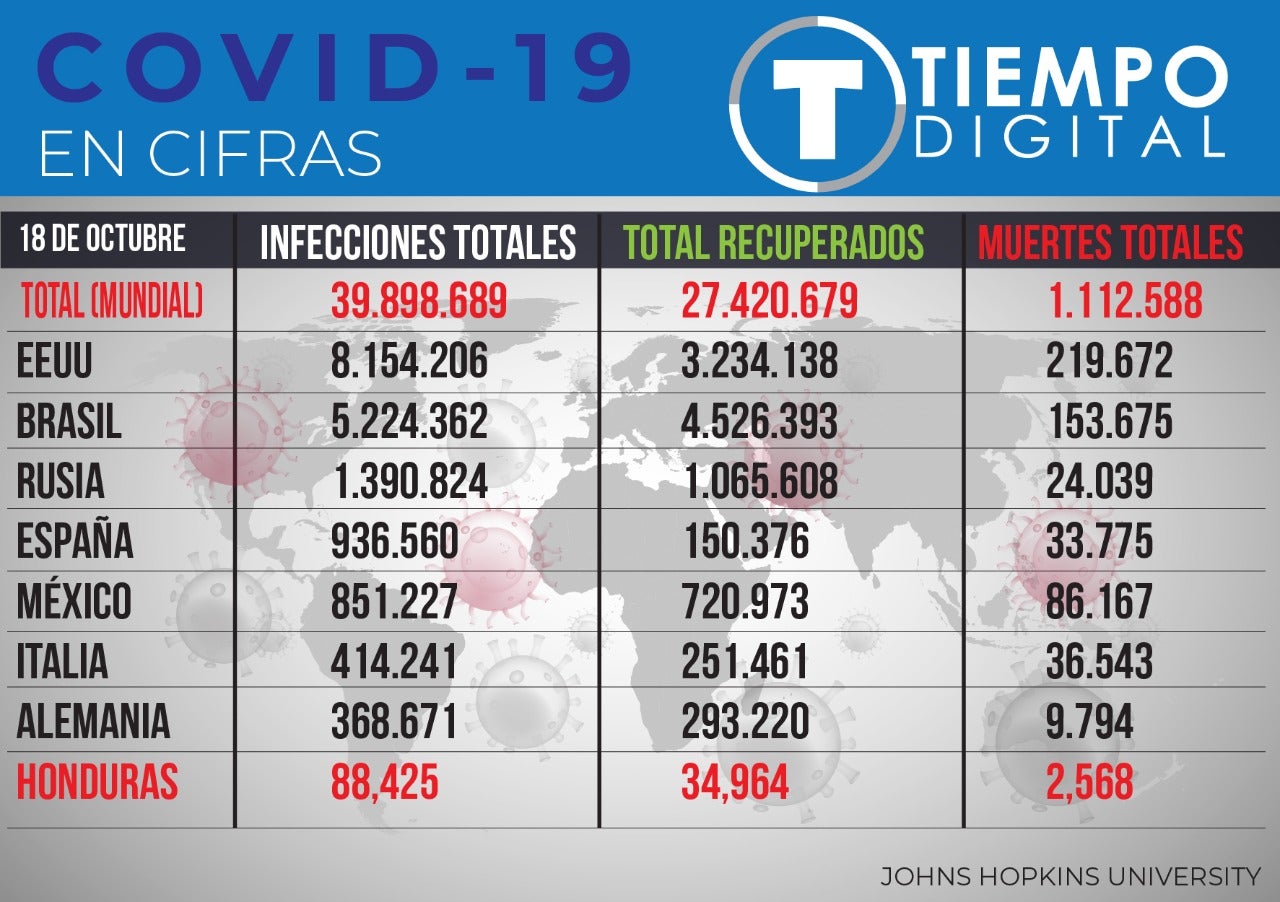
Desde la compañía esperan comprobar la eficacia de la vacuna para finales de octubre, con lo que habrían completado la primera exigencia. Un equipo de científicos independientes se encargará de analizar los resultados. Eso para poder determinar la efectividad del fármaco, que Pfizer desarrolló junto a la firma alemana BioNTech.
Puede leer: Cifras del coronavirus| Detectan COVID-19 en ojos de personas fallecidas
“Podemos saber si nuestra vacuna es efectiva o no para fines de octubre. Para hacerlo, debemos acumular una cierta cantidad de casos de COVID-19 en nuestro ensayo; para comparar la efectividad de la vacuna en individuos vacunados con aquellos que recibieron un placebo. Como debemos esperar a que ocurra una cierta cantidad de casos, estos datos pueden llegar antes o después», indicó Bourla en el comunicado.
«Como Pfizer desconoce quien recibió la vacuna, y quién el placebo; un comité formado por científicos independientes revisará los datos completos y nos informará si es efectiva o no”, agregó.
Demostrar que la vacuna es efectiva es sólo el primero de los requisitos. Después, tendrán que probar que también es segura. Para ello, la FDA exige que hayan transcurrido dos meses desde que se inyectó la segunda y última dosis a los participantes del ensayo clínico; con el fin de monitorear en ese tiempo posibles efectos adversos.
Según los datos que maneja Pfizer, cumplirán ese período en la tercera semana de noviembre; y sólo entonces podrán solicitar la autorización de emergencia.
“Nuestros estándares internos sobre la seguridad de las vacunas y los requeridos por los reguladores son altos. En el caso de la autorización de emergencia en los EEUU para una posible vacuna contra el COVID-19, la FDA exige que las empresas proporcionen dos meses de datos de seguridad de la mitad de los participantes del ensayo, después de suministrar la dosis final de la vacuna. Basados en nuestra prueba actual y el ritmo de dosificación, estimamos que alcanzaremos este hito en la tercera semana de noviembre”, reveló el CEO.
Por último, tendrán que demostrar que son capaces de producir la vacuna a gran escala. De acuerdo a Bourla, podrán facilitar estos datos antes de haber completado la fase de seguridad, es decir, antes de la tercera semana de noviembre.
“El último requisito será la presentación de datos de fabricación que demuestren la calidad y consistencia de la vacuna. Pfizer ha estado invirtiendo en riesgo desde que comenzó la pandemia para perfeccionar nuestros procesos de fabricación, y aumentar rápidamente la capacidad. Esperamos tener nuestros datos de fabricación listos para enviar antes de que se alcance el hito de seguridad”.
Con esto, para finales de noviembre EEUU podría contar con dos vacunas listas para su distribución, ya que Moderna prevé lanzar la suya también en esa fecha.
Fuente: Infobae
Suscríbete gratis a más información sobre #COVID19 en nuestro WhatsApp haciendo clic en el enlace: https://bit.ly/tiempodigitalhn
